研究テーマ
- 標的指向化を目的とした高機能・高品質(High Functionality and Quality: HFQ)脂質の設計と開発
- 生体分子認識や生体環境を利用した核酸封入脂質ナノ粒子・細胞外小胞・細胞医薬の薬物送達システムの開発
- がんやウイルス感染症に対する治療・予防法の確立を目的とした新規ワクチン製剤の開発
- 核酸を利用したデザイナー細胞の開発とがん治療への応用
- 難治性がん治療用デザイナー細菌医薬の開発に関する研究
- PETを用いたニューモダリティの薬物動態研究
- コンパニオン/プレシジョンPET画像診断薬の開発
研究内容
医薬品の開発は、21世紀において生命科学研究の進歩に伴った技術革新が起こっています。従来の低分子医薬開発は成熟化して、抗体医薬の開発が大きくすすみ、さらに現在、核酸医薬、遺伝子医薬、細胞医薬、細菌医薬、小型細胞外小胞医薬などの多様化・複雑化したモダリティが医薬品として開発されています。
複雑な次世代モダリティ(薬物)を薬剤から医薬品へと開発を進めるためには、医薬品の3要素である有効性・安全性・品質の諸問題を解析し、その問題点を論理的・総合的に克服・制御化するための技術に関する医薬品情報の創出が必要です。一方、上市された医薬品については、適正使用のための医薬品情報の創出が必要です。これら医薬品情報は、基礎研究成果である英文原著論文によって一次情報として世界中に周知され、新規医薬品の開発や適正使用がすすんでいきます。
医薬品情報学分野では、高機能・高品質(HFQ: High Functionality and Quality)脂質という独自の概念を体系化して創出する、品質保証や製造方法を考慮に入れた標的指向型DDS(Drug Delivery System)キャリアをベースにして、高い治療効果や副作用を大幅に減弱させることができる革新的な医薬品開発を行っています。また、医療応用可能な集束超音波照射や圧力刺激などの体外からの物理刺激を組み合わせてDDSキャリア単独では高効率な送達が困難な、脳や腎臓などへの送達を可能にする標的指向型DDS技術の開発も行っています。さらに、標的指向型DDS技術を応用してPET(Positron Emission Tomography)による難治性疾患の高感度な診断薬の開発を行っています。一方、次世代モダリティ医薬の標的指向型DDS技術を設計・評価していくためのPETや組織透明化の評価方法の開発もすすめています。
これらの研究を「リバース・トランスレーショナルリサーチ」の考えに即して、臨床現場で現在治療薬の無い主にがんや感染症に関する難治性疾患を対象に、研究室独自の標的指向DDS技術を基盤として、新規治療薬や診断薬の創出に関わる基礎研究を臨床の医師・薬剤師や様々な研究者と協働で推進しています。
DDS(Drug Delivery System)とは
投与部位から作用発現部位に至るまでの薬物の体内動態を一つのシステムとしてとらえ、これを場所と時間の観点から制御する技術です。DDSは薬物をより有効に、より安全に、より利便性の高い投与形態で用いるためのシステムであり、現在、医学・薬学・工学など広い学問領域で研究されています。
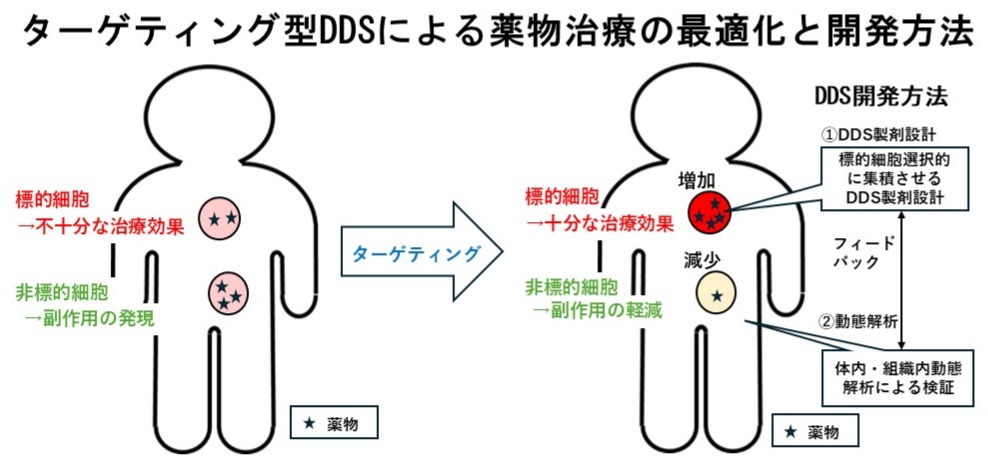
DDSは、吸収改善、放出制御、標的指向化の3つの方法論に大別されています。標的指向化は、ターゲティング(Targeting)ともよばれており、薬物による治療効果の大幅な向上と同時に副作用の大幅な軽減を実現させるための基本的な考え方になります。
ターゲティング型DDSは、難治性がんや感染症、先天遺伝子欠損疾患の治療を可能にする潜在力を持つ、核酸医薬、遺伝子医薬、細胞医薬、細菌医薬、小型細胞外小胞医薬などの次世代モダリティの実用化や高感度な診断薬開発において必要不可欠な技術です。
核酸封入脂質ナノ粒子(LNP)製剤
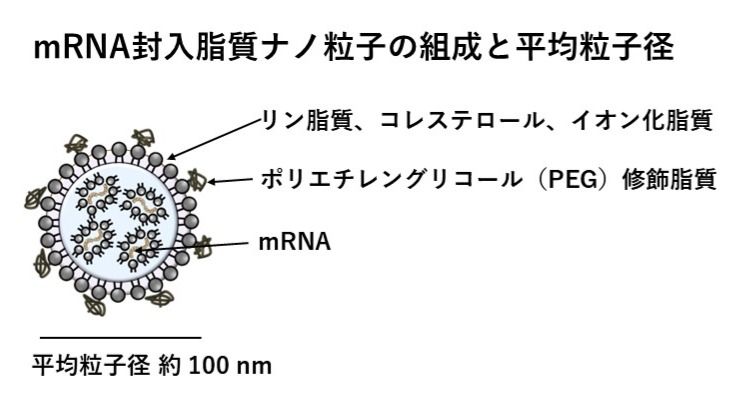
実用化された脂質ナノ粒子製剤としてはリポソームや脂質ナノ粒子があり、平均粒子径約100nmで中性電荷の脂質の集合体で内部に薬物を封入しており、代表的なDDSキャリアとして世界中で研究されています。ナノ粒子の表面は水溶性高分子であるポリエチレングリコール(PEG)で覆われており、これにより水溶中での安定性を改善したり、生体内でのマクロファージなどの細網内皮系からの貪食を免れる効果があります。PEG化リポソームはステルスリポソームともよばれ、PEGの効果によりマクロファージの貪食を避けて、未修飾のリポソームに比べて循環血液中を長期間滞留することができます。新型コロナワクチンで有名になった脂質ナノ粒子(Lipid Nanoparticle:LNP)の場合も表面はPEGで覆われ脂質成分にリン脂質、コレステロール、イオン化脂質を含んで脂質膜を形成し、内部にmRNAを封入した平均粒子径約100nmの脂質ナノ粒子です。
現在、mRNA医薬は、感染症予防mRNAワクチン、がん治療mRNAワクチン、疾患治療mRNA医薬など様々な疾患に対する治療薬が国内外で盛んに研究されています。mRNAとイオン化脂質の静電的相互作用を利用して脂質ナノ粒子内部にmRNAを封入しているため、原理上、様々なタンパク質をコードしたmRNAや他のオリゴ核酸医薬を同じ調製法を用いて脂質ナノ粒子に封入することが出来る点が特長になっています。→ 国立医薬品食品衛生研究所遺伝子医薬部HP
これらナノ粒子製剤の有効性向上と副作用軽減を目的として、ターゲティングさせるために標的細胞に親和性を持つ認識素子を結合させた脂質誘導体が開発されています。脂質部分がナノ粒子の脂質膜部分に組み込まれ、リンカーを介して認識素子がナノ粒子表面に提示されます。認識素子としては、標的細胞と特異的に結合できる抗体、ペプチド、糖鎖、アプタマーなどが研究されています。上述したようにナノ粒子表面はPEGで覆われているため、PEGによる立体障害を避けて認識素子をナノ粒子表面に提示させるためにPEGをリンカーとして用いた脂質誘導体が数多く研究されてきました。これに対して我々は下記に示す新たなアプローチの研究を行っております。
生体分子認識や生体環境を利用した核酸封入脂質ナノ粒子・細胞外小胞・細胞医薬の薬物送達システム(DDS)の開発
当研究室では、従来法とは異なり、ペプチドリンカーを持つペプチド脂質誘導体で水に高分散できるものを高機能・高品質(HFQ: High Functionality and Quality)脂質と定義して、HFQ脂質を用いた標的指向型ナノ粒子製剤の開発に関する体系的な研究を行っています。ペプチドリンカーは水への溶解が可能となるような中性電荷のものを選びますが、ヘリックス構造や非ヘリックス構造をとるかでリンカーの長さに伴った認識機構の提示による細胞認識機能や細胞取り込み機構などを変化することが分かってきています。また、双イオンペプチドリンカーを用いることで認識素子分子がナノ粒子表面で静電相互作用により近接してクラスタ―構造を形成し、従来法のPEGリンカーではみられないような新たな機能が創発すること等を見出し、その応用の可能性が広がってきています。
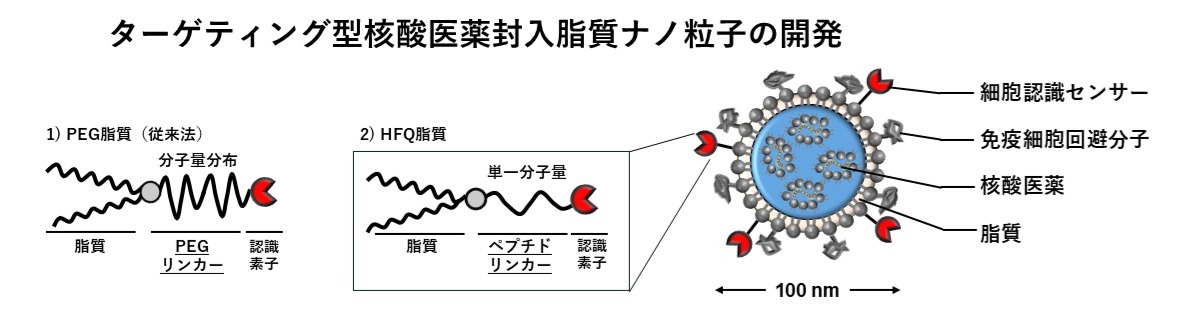
HFQ脂質を用いて調製されるターゲティング製剤は、品質保証、機能化、製造方法などで様々な利点があります。まず単一分子量分子であるためナノ粒子製剤に対する修飾量の正確な定量が可能となります。また、水に高分散できるためマイクロ流体デバイスによる迅速後修飾(Microfluidic Post-insert法)が可能になるため、スケールアップが容易となります。さらに、認識素子(リガンド分子)を配向性を制御してナノ粒子表面上に提示できるため、配向性制御化が困難な従来法であるPEGリンカーより細胞認識性が高くなることを確認しています。ここでは細胞認識素子として数多く研究されているモノクローナル抗体をリガンドとした際の脂質ナノ粒子のイメージ図を示します。
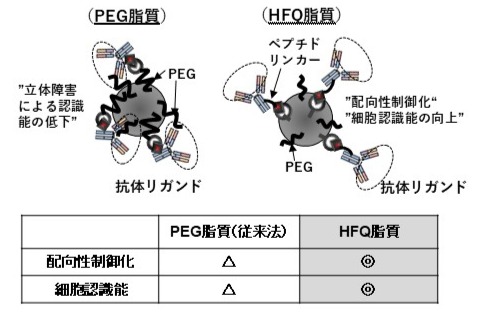
PEG脂質は分子量分布があり、HFQ脂質は単一分子量の分子です。よって、HFQ脂質はリガンド分子修飾量の正確な定量が可能です。また、後修飾法を採用しているので修飾されたリガンド分子は脂質ナノ粒子の外側を向いていると考えられます。現在、HFQ脂質はリポペプチドを基盤としたものから、その概念を拡張し、様々な機能分子を脂質ナノ粒子に迅速に付与できる製剤調製できる技術として発展しています。
当研究室では、独創性の高い様々なHFQ脂質を設計・開発し、生体分子認識や生体環境を利用した核酸封入脂質ナノ粒子・細胞外小胞・細胞医薬の薬物送達システム(Drug Delivery System:DDS)の開発を行っています。
