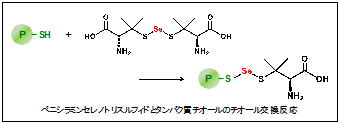
セレンは高等植物を除く多くの生物にとって必須であり,多くの場合含硫アミノ酸のシステインの硫黄がセレンに置き換わった,セレノシステイン(SeCys)としてセレンタンパク質に組み込まれ,生体内での機能を発揮しています。SeCysは,通常は終始コドンとして機能するUGAによりコードされており,セレンタンパク質のmRNAに存在する特殊なステムループ構造によりUGAをSeCysの遺伝暗号として翻訳し,セレンタンパク質が生合成されます。食事から摂取されたセレンがSeCysに合成され,このセレンタンパク質に組み込まれるまでの過程については,多くの研究が行われていますが,不明な点も残されています。これまでに当研究室では,亜セレン酸代謝過程の研究を行ってきました。その結果,セレノトリスルフィド(R1-S-Se-S-R2)とタンパク質チオール(R3-SH)とのチオール交換反応が(R1-S-Se-S-R2 + R3-SH → R1-S-Se-S-R3 + R2-SH),セレンの赤血球膜透過過程に関与していることがわかりました。
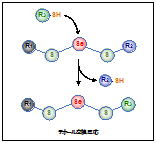
タンパク質にセレノトリスルフィド結合を介して結合したセレンは比較的安定に存在することから,セレン結合性タンパク質がセレンの保持や代謝に関与しているのではないかと考え,セレノトリスルフィドのモデル化合物であるペニシラミンセレノトリスルフィドをラットの肝細胞質溶解液を反応させ,質量分析法によりセレン結合性タンパク質を探索しました。その結果,肝臓型脂肪酸結合タンパク質(LFABP)がセレン結合性を有することがわかりました。この手法をラットの脳および心臓に応用した結果,それぞれセレン結合性タンパク質としてCystatin-12 precursorおよびmyoglobinが検出されました。現在新たなセレン結合タンパク質の探索や,これらのタンパク質がセレンを結合する生理的意義についての検討を行っています。