研究紹介
創薬薬理学の研究について
ユビキチンを付加する酵素ユビキチンリガーゼの生理機能と機能性脂質(リゾリン脂質など)の薬理的作用を細胞レベルから個体レベルで明らかにします。病態発症メカニズムを分子レベルで理解し、創薬のターゲットを提示することを目指します。生化学・分子生物学的な手法から、ゲノム編集技術により作成したノックアウトマウス、ノックインマウスを利用して、目標を達成していきます。
金子・岡元グループ
ユビキチンリガーゼの生理機能と創薬
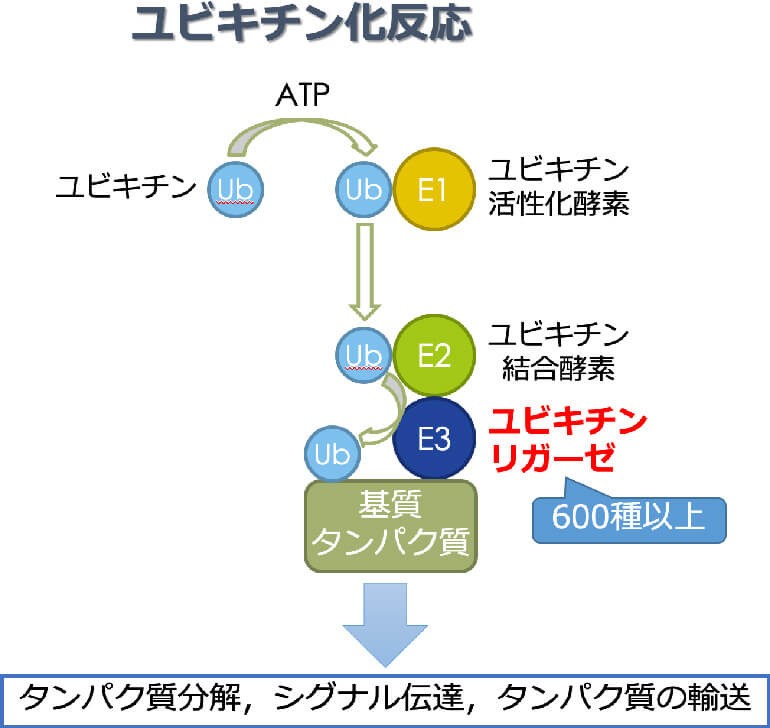
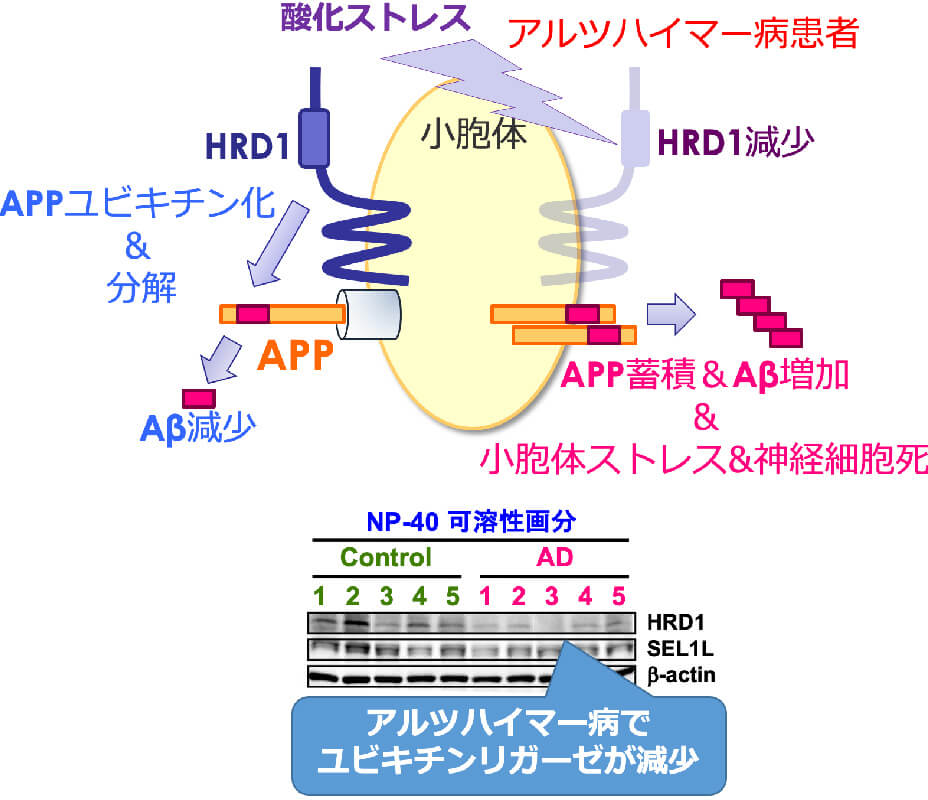
ユビキチン(Ub)は76個のアミノ酸からなる小さなタンパク質ですが、細胞内においてタンパク質のリジン残基に共有結合することで様々な生命機能(タンパク質分解・シグナル伝達・タンパク質輸送など)に関与しています。ユビキチンの基質タンパク質への修飾(ユビキチン化)を触媒する3つの酵素群がありますが、その中でユビキチンリガーゼ(E3)は基質の特異性と反応速度を規定する最も重要な酵素です。その数は600種以上あると推測されていますが、その機能に関しては不明なものが多く存在しています。私たちはこれまで新規のユビキチンリガーゼを同定し、その生理機能と疾患への関与に取り組んできました。アルツハイマー病や炎症性腸疾患などに関連するユビキチンリガーゼをこれまで見出してきましたが、今後はユビキチン化に関連した創薬にも挑戦していきます。
ユビキチンリガーゼの生理機能と疾患への関与
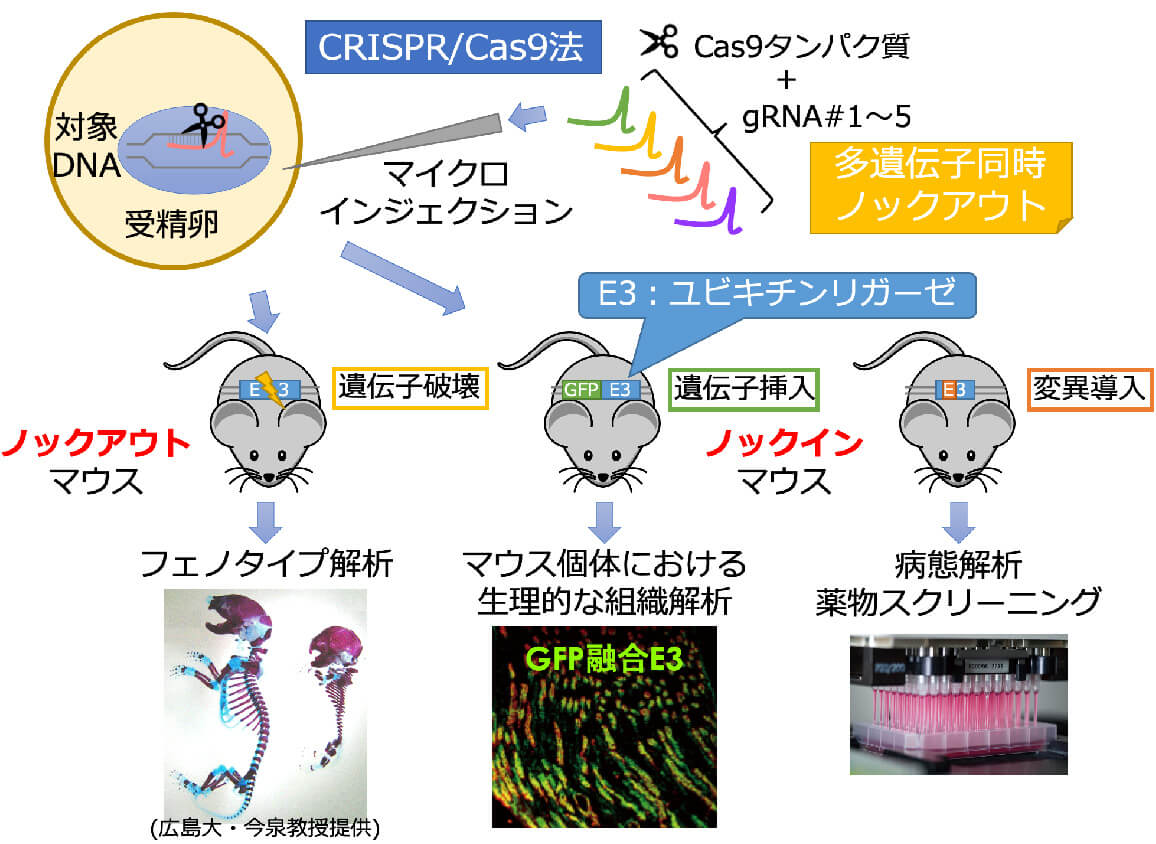
ゲノム編集を用いた遺伝子の機能解析
ゲノム編集は2013年にCRISPR/Cas9システムが開発されると急速に普及し、瞬く間に2020年のノーベル化学賞受賞研究となりました。それ程インパクトのあるツールであることを証明しています。私たちはこれまでCRISPR/Cas9システムを用いて、ノックアウト(遺伝子破壊)およびノックイン(遺伝子挿入)を細胞やマウスで行ってきました。特にCRISPR/Cas9システムによってハードルが下がったノックイン技術は強力なツールになるため、今後は様々な機能を持った遺伝子を研究対象の遺伝子に挿入することで、生理的発現レベルの遺伝子産物を細胞やマウスを用いて解析していきたいと思います。
塚原グループ
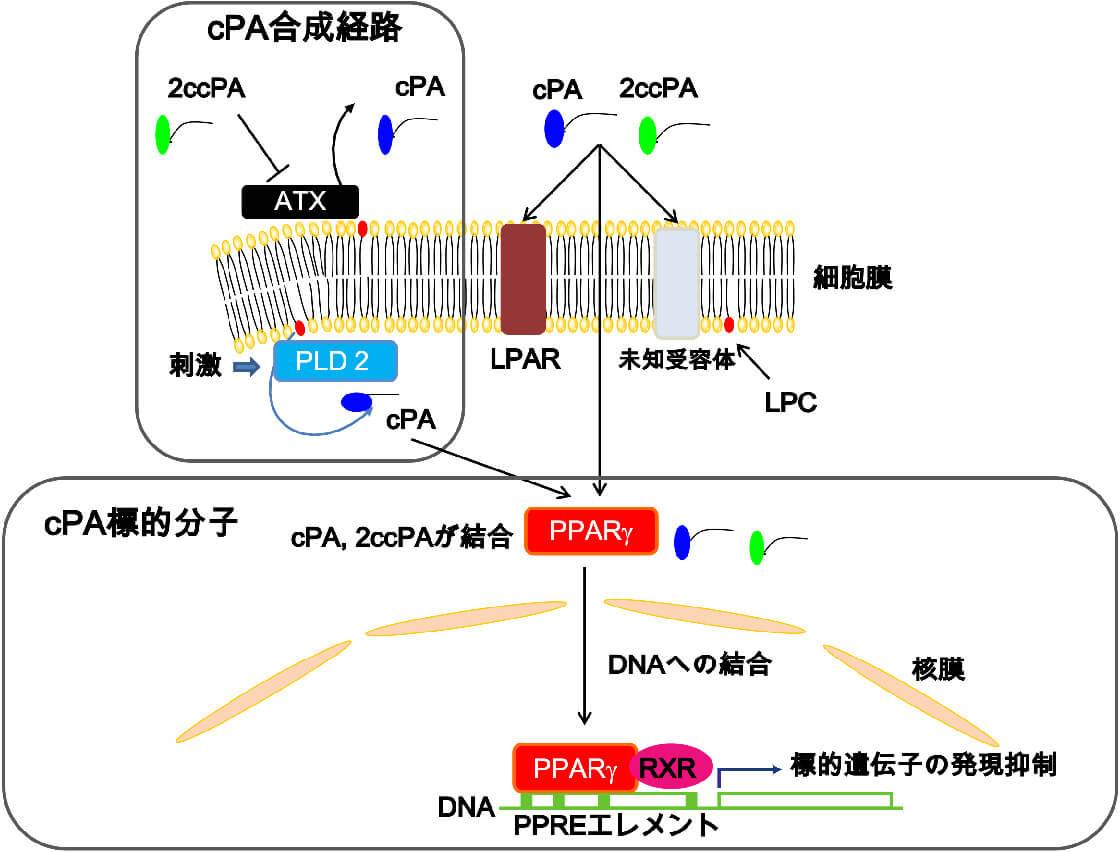
環状ホスファチジン酸に関する研究と創薬
環状ホスファチジン酸は脂質メディエーターと呼ばれ、分子量約400ダルトンの低分子化合物です。化学構造式は極めてシンプルでありながら、ユニークな生理活性を示します。私たちのプロジェクトでは、本物質が様々な疾患治療に応用できることを想定し、製薬企業と共同で基礎および臨床研究を進めています。特に、医薬品分野においては、高齢化社会を迎えてフレイル対策が重要視されており、これらの領域に絞った研究を進めています。
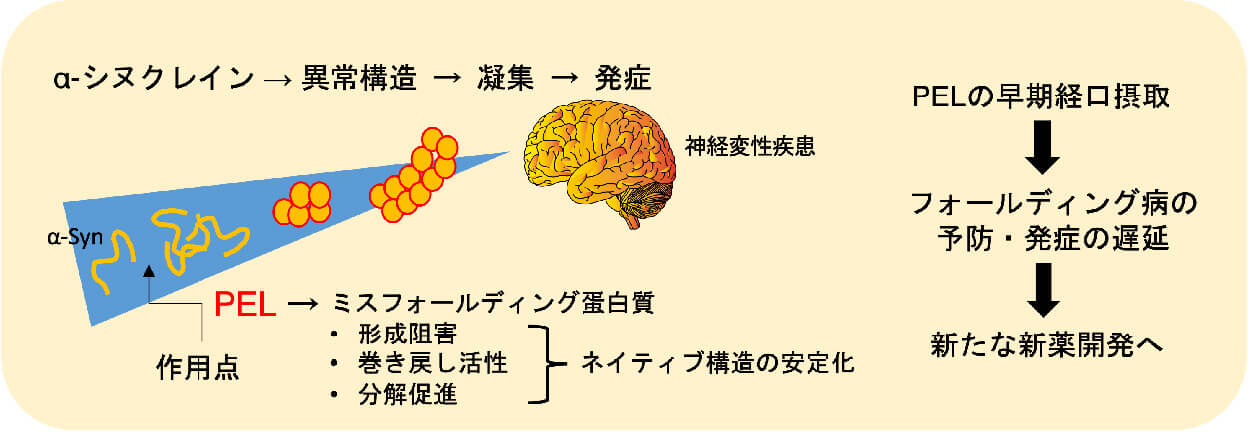
神経機能性脂質と認知機能改善効果に関する研究と創薬
超高齢化が進む日本では、認知症の対策が急務です。認知症は、血管の障害から起こる血管性の認知症と、神経細胞の変性が進んで起こる変性性の認知症に大別されます。認知症の多くは、病気の原因や対策が、いまだによくわかっていません。私たちのプロジェクトでは、そうした認知症の発症・進行のメカニズムについて研究しています。特に、神経機能性脂質をキーマテリアルとし、病態との関連性を明らかにすることで、新規の予防・治療薬の開発を目指しています。