研究テーマ Research title
研究の概要
薬剤学は、医薬品の有効かつ安全な使用を探求する学問である。他学部にはない薬学独自の学問領域で、物理薬剤学、生物薬剤学、臨床薬剤学に分類される。
- 物理薬剤学: 薬剤の物理化学的性質を調べ、最適な剤形を工夫
- 生物薬剤学: 薬剤の生体内運命を調べ、最適な薬効が得られる条件を検討
- 臨床薬剤学: 臨床における投与設計を最適化し、薬物相互作用などを検討
薬剤学分野研究テーマ概要
ドラッグデリバリーシステムの開発
近年の創薬技術の進歩は目覚ましいものがある。短期間に薬の候補化合物群を合成し、有用な生物活性を持つ化合物をスクリーニングできるようになった。薬は体内に吸収され、様々な部位に分布し、一部は代謝され、最終的に体外へと排泄される。このような薬の体内での動きは、薬効や毒性と密接な関係にある。しかし、強力な薬理効果を有するものの、生体内への吸収率が低く、速やかに分解を受ける薬も多いのが現状である。また、重篤な相互作用や副作用を招く例も後を絶たず、慎重な薬の投与が求められている。そこで、薬の吸収、分布、代謝、排泄過程を解析し、薬の生体内での動きを精密にコントロールするドラッグデリバリーシステム(Drug Delivery System, DDS)と呼ばれる新しい薬の投与形態が誕生した。
DDSは、宅配便が個人宅に荷物を指定時間に届けるように、薬を指示通り正確に、適切な時間に必要量だけ、生体内の作用点に送り届ける運搬システム「薬の宅配便」に例えられる。マイクロカプセルを利用したコントロールドリリース製剤、吸収改善を目指したプロドラッグなどが実用化されている。一方、内視鏡や超音波診断装置などの高度な医療技術を応用し、生体内の様々な部位へ薬を投与することが可能となっている。
そこで薬剤学研究室では、癌などの病巣部局所へ薬を選択的に送達するドラッグデリバリーシステム(Drug Delivery System, DDS)を確立するために、薬剤の投与経路や投与方法の工夫に着目し、肝臓などの腹腔内臓器表面からの吸収を利用した、薬の新規投与形態を開発している。さらに、生体内の特異的な取り込み機構に着目した新しい遺伝子DDS製剤を作製し、本投与方法への応用を推進している。
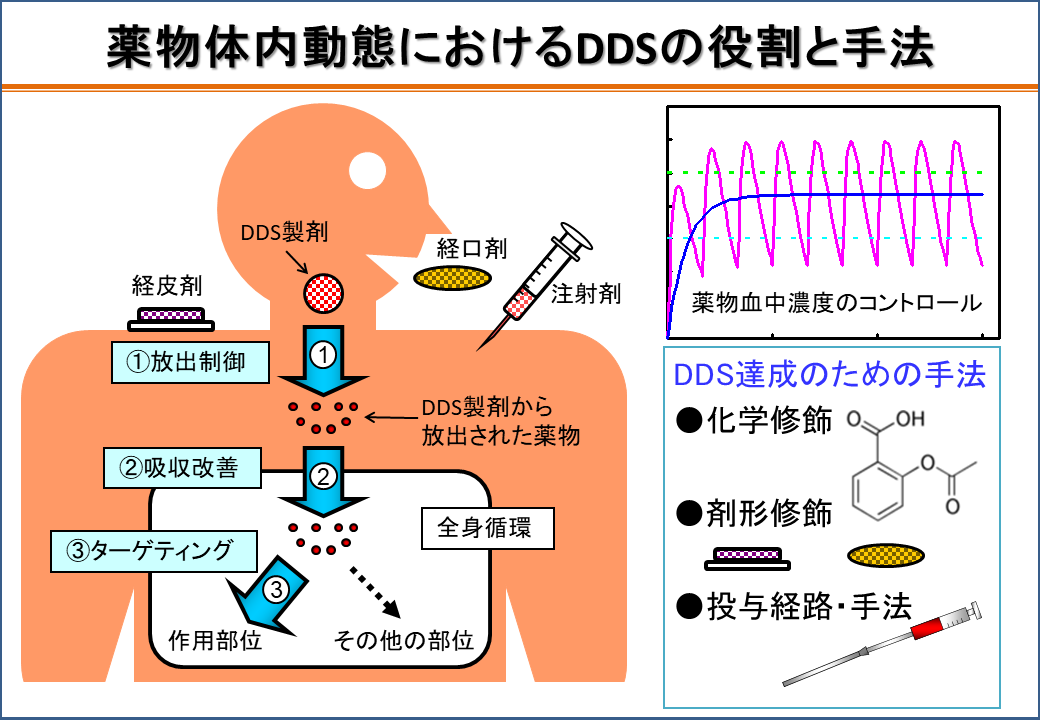
薬物体内動態におけるDDSの役割と手法
1.腹腔内の肝臓表面からの吸収を利用した薬物ターゲティング(表面投与班)
肝臓は生体の恒常性維持に重要な役割を果たしており、肝疾患には生命を左右するような重篤なものが多い。静脈などの血管系を介した薬物送達方法においては、標的臓器以外への薬物分布のために、薬効の低下や副作用が避けられないため、新規投与形態の開発が強く望まれている。この問題を解決するための有効な手段として、病巣部局所への直接投与が考えられる。例えば、臓器表面から薬物が良好に吸収された場合、薬物が臓器中の病巣部位近傍に滞留する可能性は極めて高いと予想される。しかしながら、臨床においては、経口投与や静脈内投与が主流であり、腹腔内の臓器表面からの薬物吸収に関する報告例は見当たらない。
そこで肝臓局所への薬物の集積性改善を最終的な目的として、有機アニオン系色素や分子量の異なるデキストラン類をモデル薬物として選択し、薬物吸収を肝臓表面に限定できる拡散セルを新たに作製し(上図)、肝臓表面からの薬物吸収のメカニズムの解明を行った。物性の異なる各種モデル化合物が、肝臓表面から良好に吸収され投与部位近傍に高濃度で分布し、薬物の物性に基づいて肝臓表面からの吸収動態を予測できる可能性を示した。さらに、抗癌薬5-FUにおける同様な肝指向性を確認した。
次の段階として、新規投与形態の臨床応用へ向けて、薬物の肝臓表面からの吸収性や局所滞留性に及ぼす、投与薬液の容量や適用面積、粘性添加物などの影響を明らかにした。これらの製剤学的因子を適宜調節し、継続的な微量注入、薬物の高分子化修飾等による肝指向性増強の手法と組み合わせ、空間的・時間的に理想的な肝臓内薬物分布が得られる肝臓表面適用製剤の至適条件を考察している。また、ゲノム製剤や抗癌薬に対する本投与法の適用において、実用化のための基盤構築を目指して、臓器表面適用シート製剤の開発を精力的に展開している。
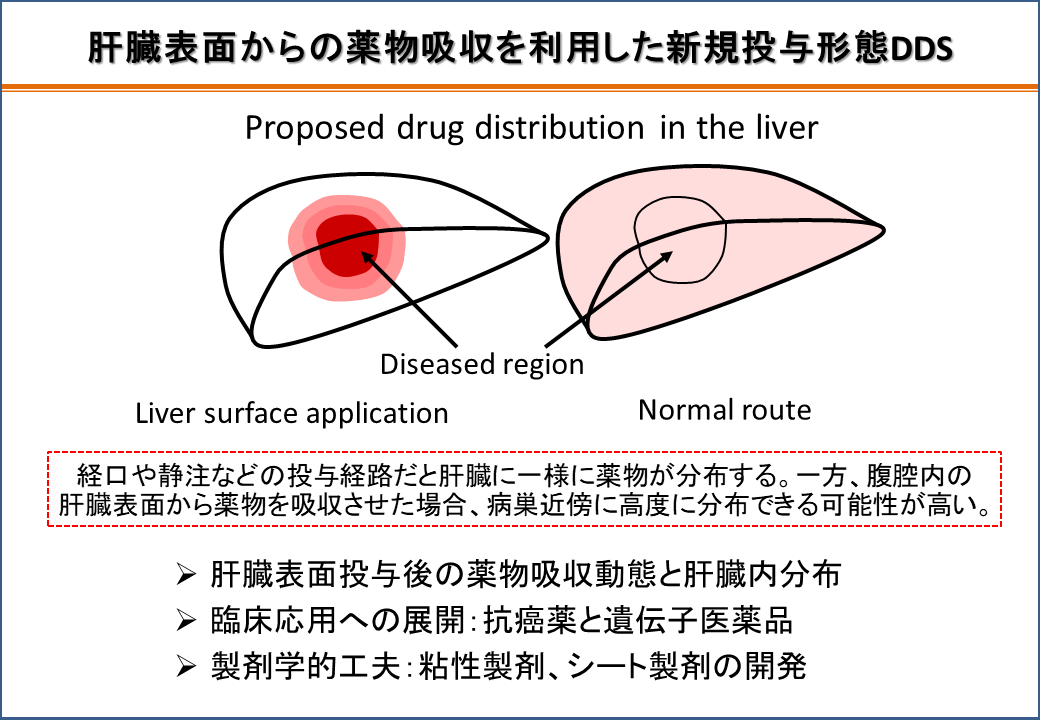
腹腔内の肝臓表面への新規投与形態DDS
[代表論文]
- Nishida K et al: Regional delivery of model compounds and 5-Fluorouracil to the liver by their application to the liver surface in rats: its implication for clinical use, Pharmaceutical Research, 22, 1331-1337, 2005 PMID:16078143
- Nishida K: 肝臓表面からの吸収を利用した薬物送達システムの開発とその展開, YAKUGAKU ZASSHI, 129: 925-932 (2009) PMID:19652498
- Nishida K et al: Relationship between lipophilicity and absorption from the liver surface of paraben derivatives and antipyrine in rats. J Pharm Pharmacol 63: 736-740, 2011 PMID:21492176
- Kodama Y, Nishida K et al: Effect of viscous additives on the absorption and hepatic disposition of 5-Fluorouracil (5-FU) after application to liver surface in rats. J Pharm Pharmacol. 64: 1438-1444, 2012 PMID: 22943174
2.遺伝子治療実現に向けた遺伝子デリバリー研究(遺伝子班)
先天性遺伝子欠損症、癌など難治性疾患に対して遺伝子医薬品の開発が強く望まれているものの、効果と安全性の両面を満たす遺伝子導入法は少ないのが現状である。これまでに長崎大学薬学部 薬剤学研究室では、新規投与経路として肝臓、胃など腹腔内臓器表面に直接、非ウイルスベクターであるプラスミドDNAを滴下することで、安全に遺伝子導入可能であることを報告している。さらに、プラスミドDNAによる遺伝子導入のメカニズムとして、Rac介在性シグナル伝達経路の活性化により起こるマクロピノサイトーシスが重要であることを明らかにした。このことは、マクロピノサイトーシスの活性化剤の併用により遺伝子導入効率を改善できる可能性を示しているものと思われ、現在、遺伝子導入効率を改善できる物質の探索を行い、安全性を保ちながら効率的な遺伝子導入法を開発しつつある。
一方、遺伝子医薬品の血管内投与時においては、ベクターと血液成分との相互作用が問題となる。これまでに非ウイルス性ベクターについて解析を行い、血液成分との相互作用が及ぼす影響について明らかにしつつある。こうして得られた情報を基に、安全かつ効率的な新規ベクターの設計を行い、現在、開発を行っている。
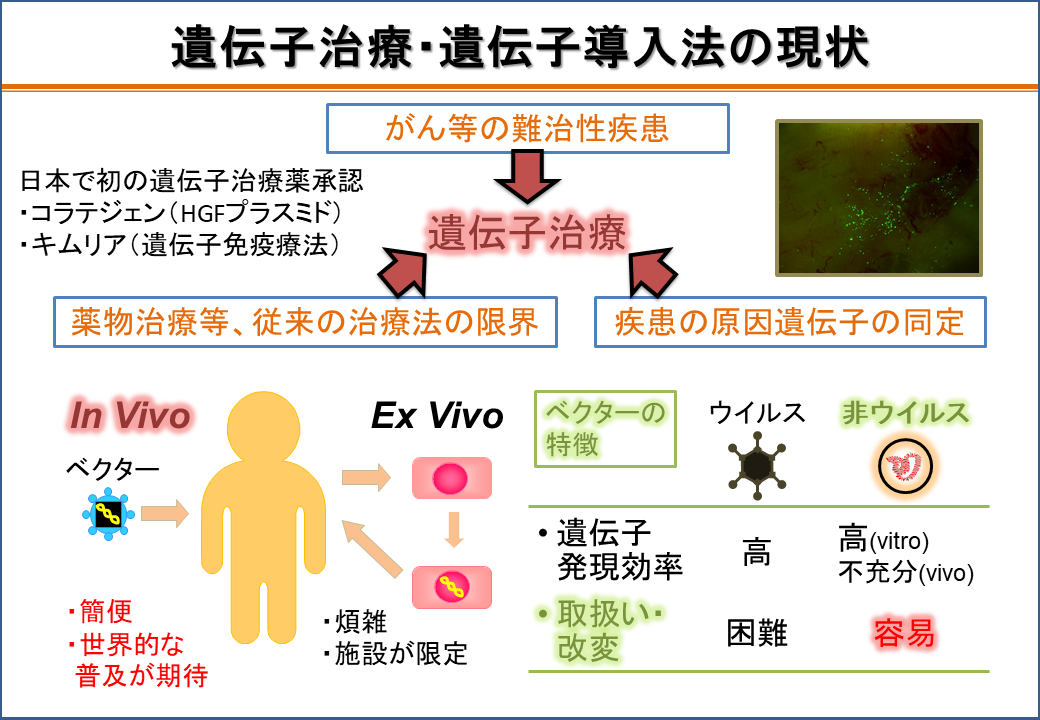
遺伝子治療・遺伝子導入法の現状
[代表論文]
- Fumoto S: 非ウイルス性ベクターによる臓器・部位・細胞選択的遺伝子導入法に関する研究, YAKUGAKU ZASSHI, 129: 1055-1061 (2009) PMID:19721381
- Fumoto S et al, Rac-Mediated Macropinocytosis Is a Critical Route for Naked Plasmid DNA Transfer in Mice. Molecular Pharmaceutics. (2009) 6:1170-1179. PMID:19492848
- Yoshikawa N, Fumoto S et al: Multiple components in serum contribute to hepatic transgene expression by lipoplex in mice. J Gene Med 13: 632-643, 2011. PMID:22002583
- Fumoto S et al: Efficient in vivo gene transfer by intraperitoneal injection of plasmid DNA and calcium carbonate microflowers in mice, Molecular Pharmaceutics, 9: 1962-1970, 2012. PMID:22670625
3.病態時および各種治療時における薬物療法の個別化(動態班)
体内に投与された薬物は、体内に吸収され、様々な部位に分布し、一部は代謝され、最終的に体外へ排泄される。また、薬物が体に有益な効果を発揮するには、最適な濃度範囲(治療域)があり、治療域に達しない場合は効果を示さず(無効)、逆に治療域より高い濃度では、薬は体にとって毒になり、副作用の原因となる。しかし、患者の病気や併用薬などの影響で、薬物の動きは変化しやすいために、重篤な薬物相互作用や副作用を招く例も後を絶たず、薬物療法の個別化が望まれている。
このような背景の元、病態時(肝・腎疾患、腹膜障害)や各種治療時(低体温療法、ハイパーサーミア療法)における薬物の体内動態変動を、様々な実験系(in vivo全身系、in situ臓器灌流系、in vitro細胞系)を活用して薬物速度論的に系統的に解析している。得られた実験結果に基づいて、最適な投与計画の立案を行うための検討や、病態時における薬物動態特性の違いを利用した診断薬の開発などを行っている。
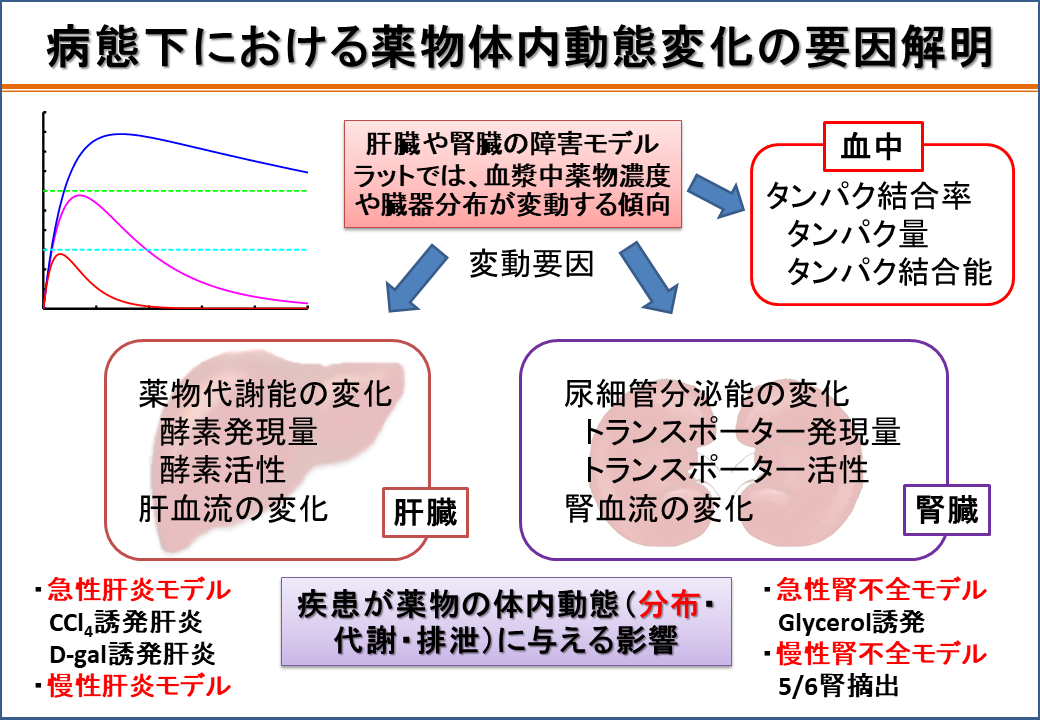
病態下における薬物体内動態変化
[代表論文]
- Miyamoto H et al: Evaluation of changes in hepatic disposition of phenolsulfonphthalein, indocyanine green and fluorescein isothiocyanate-dextran at low temperatures using a rat liver perfusion system. J Pharm Pharmacol. 2012 64:848-854 PMID:22571263
- Miyamoto H et al: Evaluation for effect of hypothermia on the disposition of 4-nitrophenol in rats by in vitro metabolism study and rat liver perfusion system. J Pharm Pharmacol. 2013 65: 1536-1540 PMID:24028621
- Fumoto S et al: Evaluation of enhanced peritoneum permeability in methylglyoxal-treated rats as a diagnostic method for peritoneal damage, Pharm. Res., 24: 1891-1896, 2007 PMID:17476464
- Hirata H, Fumoto S et al: Novel diagnostic method of peritoneal injury using dual macromolecular markers, Biol. Pharm. Bull., 37: 262-267, 2014 PMID:24492723
