ミトコンドリアのストレス受容・応答機構
ミトコンドリアは、エネルギー産生の中枢機関として細胞の生存を支えると同時に、さまざまな細胞の機能制御から細胞死の誘導に至るまで、きわめて多彩な働きを持ちます。しかし、ストレスにさらされた細胞のミトコンドリアでは、活性酸素種の過剰産生、ミトコンドリアDNAの損傷、マトリックスへの不良タンパク質の蓄積など、さまざまな障害が起こります。このような障害は、アポトーシスやネクローシスの誘導などによって細胞の運命に大きな影響をもたらし、がん、代謝疾患、神経変性疾患などさまざまな疾患の原因となると考えられています。よって、ミトコンドリアの障害や機能低下の状況を、ミトコンドリアの品質管理システムや他のオルガネラに向けてシグナルとして発信する機構が存在し、その機構が細胞のストレス応答だけではなく、細胞の機能調節においても重要な役割を担っていると予想されます。
私たちがストレス応答キナーゼASK1の結合分子として見いだしたPGAM5は、そのようなミトコンドリアの機能低下をストレス応答シグナルに変換する機構の一翼を担う分子であることが分かってきました。この分子は、これまでに知られていたいずれの分子とも相同性を持たない、まったく新しいタイプのセリン・スレオニン特異的プロテインホスファターゼとして機能し、その活性依存的にASK1ならびにその下流の MAPキナーゼ経路を活性化することが私たちの解析により明らかとなりました(発表論文1)。
PGAM5のC末端側には、解糖系で働くホスホグリセリン酸ムターゼ(PGAM)と高い相同性を持つPGAMドメインが存在します。そのため、当初はPGAM活性を持つ代謝酵素と思われましたが、実際にはPGAM活性は持たず、プロテインホスファターゼとして機能することが分かりました。分子構造的にはこれまでの既知のプロテインホスファターゼファミリーには収まらない分子であり、最近明らかとなった他のユニークな構造的特徴を持つホスファターゼ分子とともに「アティピカル・プロテインホスファターゼ」ファミリーの構成分子と位置づけられています(発表論文2)。
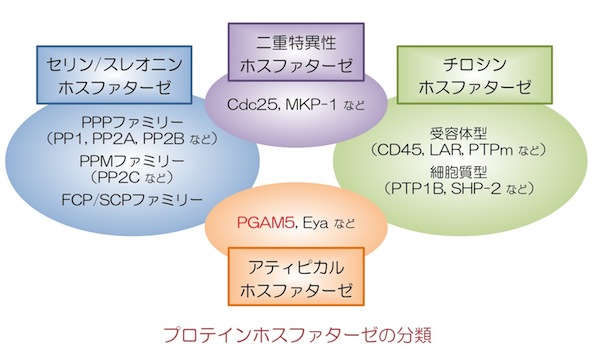
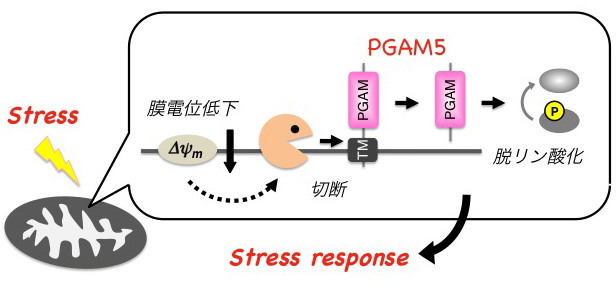
PGAM5のN末端側には膜貫通ドメインが存在し、それを介してミトコンドリアの内膜に局在していることが分かりました。興味深いことに私たちは、さまざまな細胞傷害性ストレスによって引き起こされるミトコンドリアの機能低下(膜電位低下)にともなって、PGAM5が分子内で切断されることを明らかにしました(発表論文3)。よってPGAM5は膜電位低下に応答して切断を受け、おそらくはその局在やホスファターゼとしての活性を変化させることで、ミトコンドリアの状況を他の分子にシグナルとして伝達する役割を担っていると予想されます。
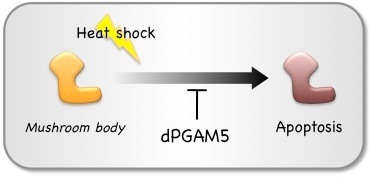
PGAM5が生体においてどのような役割を担っているかを探るために、私たちはショウジョウバエの系を用いて解析を行いました。PGAM5は種を越えて高度に保存されたタンパク質で、ショウジョウバエPGAM5 (dPGAM5)も哺乳類PGAM5と同様にセリン・スレオニン特異的プロテインホスファターゼとして機能します。解析の結果、ショウジョウバエのPGAM5欠損変異個体が熱ショックストレスに脆弱であり、それがmushroom body(キノコ体)と呼ばれる脳組織における神経細胞のアポトーシスの亢進によることを見いだしました。よってPGAM5は、少なくともある特定の神経細胞において熱ショック誘導性アポトーシスの抑制に働く活性を持つと考えられ、生体のストレス応答において重要な役割を担っていることが明らかとなりました(発表論文4)。
マウスにおいても欠損個体(PGAM5 KOマウス)を作製して解析を進めていますが、通常の飼育条件では、PGAM5 KOマウスと野生型マウスとの明らかな違いは認められていません。しかし、飢餓状態かつ低温という厳しいストレス下において、PGAM5 KOマウスでは長時間にわたって体温が維持されることが明らかとなりました(発表論文5)。その際、KOマウスでは、血清中の中性脂肪が減少し、熱産生の中枢である褐色脂肪組織における脂肪の蓄積が著しく減少していることから、脂質代謝が亢進していると考えられました。しかし、褐色脂肪組織の電子顕微鏡解析を行ってみると、飢餓・低温ストレスによって、異常な形態を示すミトコンドリアが野生型マウスよりKOマウスで増加していることが分かりました。このような結果から、PGAM5はミトコンドリアにおける脂質代謝を一定のレベルに止める役割を担っており、ミトコンドリアがストレスに過剰に応答して疲弊することを防いでいる可能性が考えられます。さらにPGAM5 KOマウスでは、高脂肪食摂取による体重増加が抑制され、様々な臓器における脂肪蓄積も減少していました。この表現型も脂質代謝亢進の結果と考えられることから、PGAM5はミトコンドリアにおける脂質代謝を調節することで、個体レベルのストレス応答に働くことが示唆されます。
最近、多くのグループから、細胞死、炎症、免疫応答などにおけるPGAM5の新たな分子機能が提唱されています。私たちは、それらの知見を検証しながら引き続きPGAM5の機能の解明を進め、ミトコンドリアにおけるストレス受容・応答機構とその細胞全体の応答における役割、さらには個体レベルでの役割を明らかにしたいと考えています。
発表論文
1. Takeda K, Komuro Y, Hayakawa T, Oguchi H, Ishida Y, Murakami S, Noguchi T, Kinoshita H, Sekine Y, Iemura S, Natsume T, Ichijo H
Mitochondrial phosphoglycerate mutase 5 uses alternate catalytic activity as a protein serine/threonine phosphatase to activate ASK1.
Proc Natl Acad Sci USA 106, 12301-12305 (2009)
2. Sadatomi D, Tanimura S, Ozaki K, Takeda K
Atypical protein phosphatases: emerging players in cellular signaling.
Int J Mol Sci 14, 4596-4612 (2013)
3. Sekine S, Kanamaru Y, Koike M, Nishihara A, Okada M, Kinoshita H, Kamiyama M, Maruyama J, Uchiyama Y, Ishihara N, Takeda K, Ichijo H
Rhomboid protease PARL mediates the mitochondrial membrane potential loss-induced cleavage of PGAM5.
J Biol Chem 287, 34635-34645 (2012)
4. Ishida Y, Sekine Y, Oguchi H, Chihara T, Miura M, Ichijo H, Takeda K
Prevention of apoptosis by mitochondrial phosphatase PGAM5 in the mushroom body is crucial for heat shock resistance in Drosophila melanogaster.
PLoS ONE 7, e30265 (2012)
5. Sekine S, Yao A, Hattori K, Sugawara S, Naguro I, Koike M, Uchiyama Y, Takeda K, Ichijo H
The ablation of mitochondrial protein phosphatase PGAM5 confers resistance against metabolic stress.
EBioMedicine 5, 82-92 (2016)
6. Chaikuad A, Filippakopoulos P, Marcsisin SR, Picaud S, Schröder M, Sekine S, Ichijo H, Engen JR, Takeda K, Knapp S
Structures of PGAM5 provide insight into active site plasticity and multimeric assembly.
Structure 25, 1089-1099 (2017)
7. Yamaguchi A, Ishikawa H, Furuoka M, Yokozeki M, Matsuda N, Tanimura S, Takeda K
Cleaved PGAM5 is released from mitochondria depending on proteasome-mediated rupture of the outer mitochondrial membrane during mitophagy.
J Biochem 165, 19-25 (2019)
8. Baba T#, Tanimura S#, Yamaguchi A#, Horikawa K, Yokozeki M, Hachiya S, Iemura S, Natsume T, Matsuda N, Takeda K (#; equally contributed authors)
Cleaved PGAM5 dephosphorylates nuclear serine/arginine-rich proteins during mitophagy.
BBA Mol Cell Res 11868, 119045 (2021)
9. 武田 弘資
ミトコンドリア・プロテインホスファターゼ ーオルガネラ機能制御からシグナル伝達へー.
実験医学増刊「シグナリング研究 2015」33 (10), 1522-1528 (2015)
10. 武田 弘資
注目され始めた“アティピカル・プロテインホスファターゼ”.
細胞工学 30 (6), 626-630 (2011)


