細胞運動は、細胞内で生じる多彩な反応が時空間的に緻密かつ統合的に調節されることで成り立つ細胞応答であると考えられます。しかし、その制御機構の緻密さがゆえに、わずかな調節の不全であっても的確な制御が失われ、それが疾患発症の引き金になることが予想されます。その現象の代表的な例が腫瘍の悪性化であり、細胞運動制御機構が適切に機能しなくなると、やがてがん細胞の浸潤転移能の獲得へと繋がっていきます。そのため、細胞運動を制御する分子機構の解明は、「制がん」の観点からも重要な研究課題であると考えられています。
私たちは、多彩な細胞応答の誘導において中心的な役割を果たしているMAPキナーゼ経路のなかで、特にERK-MAPキナーゼ経路(ERK経路)に着目して、細胞運動制御におけるその役割について解析を進めてきました。その成果として、ERKが転写因子Elk-1の持続的なリン酸化を介してMatrix metalloproteinase (MMP)-9などの遺伝子発現を誘導することで細胞運動を促進させること(発表論文1)、ERK経路の恒常的活性化がMMP-3/-9/-14などの発現亢進を引き起こし、それががん細胞の高い浸潤能の獲得に繋がること(発表論文2)、すなわち、ERK経路が細胞運動の調節において重要な役割を果たしていることを明らかにしてきました。
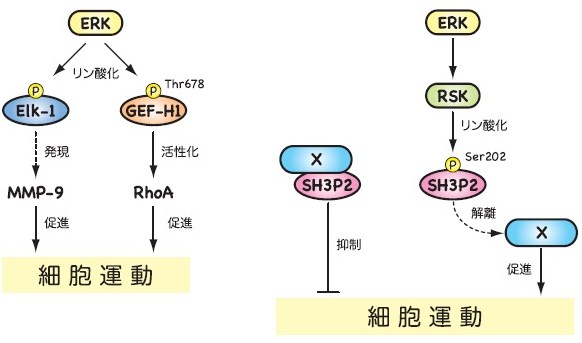
また、ERK がRhoA活性化因子であるGEF-H1の678番目のスレオニン残基をリン酸化することにより、GEF-H1のRhoA活性化能を亢進することを見いだしました(発表論文3)。低分子量Gタンパク質の一種であるRhoAはアクチン骨格の形成制御を通して細胞運動を調節することが知られています。よって、ERKはGEF-H1のリン酸化を介してRhoAの活性化を促し、それにより細胞運動の亢進に寄与すると考えられます。
さらに最近になって、私たちは発現クローニング法を利用して細胞運動制御に関わる分子の探索を進めたところ、細胞運動を抑制する新たな分子としてSH3P2を同定しました。また、その後の解析により、SH3P2は202番目のセリン残基(Ser202)がERKの下流に位置するRSKによって直接リン酸化されること、そのリン酸化によってSH3P2の細胞運動を抑制する能力がキャンセルされることを突き止めました(発表論文4)。すなわち、SH3P2はERK経路によって制御を受ける新たな細胞運動調節因子であると考えられます。
現在は、SH3P2の機能解明を中心に解析を行っています。これまでに、SH3P2に結合する分子を同定し、その分子がERK経路に依存したSH3P2のSer202のリン酸化によってSH3P2から解離することなどを見いだしつつあり、私たちが新たに見いだしたERK-RSK-SH3P2による細胞運動制御機構の全容解明を目指して研究を進めています。
発表論文
1. Tanimura, S., Nomura, K., Ozaki, K., Tsujimoto, M., Kondo T. and Kohno, M.
Prolonged nuclear retention of activated extracellular signal-regulated kinase 1/2 is required for hepatocyte growth factor-induced cell motility.
J. Biol. Chem., 277, 28256-28264 (2002).
2. Tanimura, S., Asato, K., Fujishiro, S. and Kohno, M.
Specific blockade of the ERK pathway inhibits the invasiveness of tumor cells: down-regulation of matrix metalloproteinase-3/-9/-14 and CD44.
Biochem. Biophys. Res. Commun., 304, 801-806 (2003)
3. Fujishiro, S., Tanimura, S., Mure, S., Kashimoto, Y., Watanabe, K. Kohno, M.
ERK1/2 phosphorylate GEF-H1 to enhance its guanine nucleotide exchange activity toward RhoA.
Biochem. Biophys. Res. Commun. 368, 162-167 (2008)
4. Tanimura, S. Hashizume, J., Kurosaki, Y., Sei, K., Gotoh, A., Ohtake, R., Kawano, M., Watanabe, K. and Kohno, M.
SH3P2 is a negative regulator of cell motility whose function is inhibited by ribosomal S6 kinase-mediated phosphorylation.
Genes Cells 16, 514-526 (2011)
|
